分子间氢键
分子间氢键是分子间有氢键的液体,粘度一般较高。
氢键含义 编辑本段
例如甘油、磷酸、多羟基化合物如浓硫酸通常是粘性液体,因为分子间形成了大量氢键。分子内氢键,熔化、沸点常降低。比如分子内有氢键的邻硝基苯酚的熔点(45℃)与分子间氢键的元熔点相比(96℃)和对位熔点(114℃)都低。
氢键分类 编辑本段
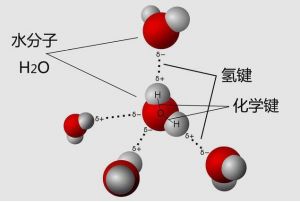
分子间氢键
现在以HF为例说明氢键的形成。在HF分子中,由于f的电负性(4.非常大,共享电子对强烈地向F原子一侧倾斜,而H核外只有一个电子由于它的电子云转移到F原子,它几乎处于质子状态。这个半径很小、带有部分正电荷而没有内电子的氢原子,使得附近另一个HF分子中带有孤电子对和部分负电荷的F原子有可能充分靠近它,从而产生静电引力。这种静电吸引叫做氢键。氢键只能存在于同种分子之间,不同种类的分子之间也可能形成氢键。
分子内氢键
在一些分子中,比如HNO,、邻硝基苯酚分子可以形成分子内氢键。分子内氢键受环状结构限制,x-H…y经常可以 不在一条直线上。
形成条件 编辑本段
1与高电负性原子A 2形成强极性键的氢原子具有较小的半径、较大电负性、含孤电子对、部分带负电的原子b(F、O、N)氢键的本质:强极性键(A-H)氢原子上的原子核,电负性很大、具有孤电子对和部分负电荷的原子B之间的静电引力。3氢键的通式
如果氢键的情况写成通式,可以用X-H…Y①表示。其中X和Y代表电负性大原子半径小的非金属原子,如FOn。x和y可以是两个相同的元素或两个不同的元素。⑷对氢键的理解尽管氢键非常普遍,对它的研究也在逐渐深入,但人们对氢键的定义仍然有两种不同的理解。第一种把X-H…Y的整个结构叫氢键,所以氢键的键长是指X和Y之间的距离,比如f-H…f的键长是255pm。第二种把H…y叫做氢键,所以h…f之间的距离是163pm,这是氢键的键长。在选择氢键长度的数据时,我们应该注意这种差异。但是对氢键能的理解是一样的,就是把x-H…Y-H分解成HX和HY所需的能量。
氢键强度 编辑本段
氢键——键强度的牢固程度也可以用键能来表示。粗略地说,氢键能是指单位物质中H的量…Y键所需的能量。氢键的键能一般是42kJ·摩尔以下,键能远小于共价键,但更接近分子间力。比如水分子中共价键和氢键的键能不同。
而且氢键的形成和破坏所需的活化能也较小,其形成的空间条件也容易出现,所以在物质不断运动的情况下,氢键可以不断地形成和断裂。
性质影响 编辑本段
氢键通常在物质处于液态时形成,但有时形成后也能继续存在于一些结晶甚至气态物质中。例如在气态、氢键存在于液态和固态HF中。有很多物质可以形成氢键,比如水、水合物、氨合物、无机酸和一些有机化合物。氢键的存在影响物质的某些性质。
1)熔点、当沸腾分子间有氢键的物质熔化或气化时,除了克服纯分子间力外,还需要提高温度,供给额外的能量来破坏分子间的氢键,所以这些物质的熔点、沸点比系列氢化物的熔点、沸点高。分子内氢键,熔化、沸点常降低。比如分子内有氢键的邻硝基苯酚的熔点(45℃)与分子间氢键的元熔点相比(96℃)和对位熔点(114℃)都低。
2)在极性溶剂中的溶解度,如果溶质分子和溶剂分子之间能形成氢键,溶质的溶解度就会增加。HF和NH3在水中的溶解度比较大,就是这个原因。
3)分子间有氢键的液体粘度一般较高。例如甘油、磷酸、多羟基化合物如浓硫酸通常是粘性液体,因为分子间形成了大量氢键。
4)如果密度液体的分子之间形成氢键,就可能发生缔合作用,如液态HF正常情况下,除了正常简单的HF分子外,还有氢键连接的复杂分子(HF)n。nHF(HF)n
其中n可以是234…这种将几个简单分子结合成复杂分子而不改变原物质化学性质的现象称为分子缔合。分子缔合的结果会影响液体的密度。
HO分子之间也有关联。
在室温下的液态水中,不仅有简单的HO分子,还有(H2O)2,(H2O)3,…,(H2O)n等结合分子的存在性。降低温度有利于水分子的结合。当温度降到0℃时,所有的水分子形成一个巨大的联合体——冰。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。