浓硫酸
浓硫酸,俗称坏水,化学分子式为H₂SO₄,是一种强无机酸,腐蚀性很强。浓硫酸是指质量分数大于等于70%的硫酸溶液。浓硫酸在高浓度下有很强的氧化性,这是它和稀硫酸最大的区别之一。同时,它还具有脱水性强腐蚀性难挥发性酸性吸水性等。
质量分数大于或等于70的浓硫酸%硫酸水溶液,俗称坏水。浓硫酸有很强的腐蚀性:在常压下,沸腾的浓硫酸能腐蚀除铱钌以外的所有金属,它能腐蚀的金属元素数量甚至超过王水。硫酸在高浓度下有很强的氧化性,这是它和稀硫酸最大的区别之一。同时还具有脱水性难挥发性酸性吸水性等。与硝酸类似,还原产物可能是二氧化硫单质硫或硫化物,它们受还原剂类型和用量的影响。
化学定义 编辑本段
浓硫酸是指质量分数大于等于70%纯H2SO4水溶液。
硫酸硝酸盐酸氢碘酸氢溴酸高氯酸并称为化学中的六大无机强酸。
性质
因为浓硫酸包含大量非离子化的硫酸分子(强酸溶液中的酸分子不一定都电离成离子,酸的强弱是相对的),所以浓硫酸有吸水性、脱水性(俗称碳化,即腐蚀性)和强氧化性;在稀硫酸中,硫酸分子已经完全电离,所以它不具有浓硫酸的特殊化学性质。富马酸是无色或棕色油状粘稠发烟液体(棕色是因为它含有少量的铁离子)有强烈的刺激性气味,吸水性强,可与水任意比例混合,并放出大量稀释热。因此,稀释浓硫酸时,应沿着容器壁将浓硫酸慢慢注入水中,并用玻璃棒不断搅拌。
与稀硫酸 编辑本段
硫酸的浓度和稀释概念有一个通用标准:发烟硫酸的最高密度约为2,它含有约60的游离SO3%一般来说,密度是1.61g/毫升硫酸称为浓硫酸(注:一般认为浓度为70%上面的硫酸叫浓硫酸)其中还原SO3含量达到82%它的浓度是18摩尔/l介质浓度是指密度为1.5到1.在8左右,它们的浓度是9.2mol/L到16mol/L。那么稀硫酸意味着密度是1.5g/mL以下,浓度为9.2mol/L以下。
鉴别方法 编辑本段
1.称重法
浓硫酸比稀硫酸密度大(98%浓硫酸的密度是1.84g/mL),所以在同样的体积下,重的是浓硫酸。
2.粘度法
浓硫酸是粘稠液体,而稀硫酸接近水的粘度,所以可以拿起试剂瓶摇晃几下,看看哪个是浓硫酸当液体充满时,在试管中稍微振荡一下为宜。但是没有控制的时候不建议。
3.沸点法
硫酸是一种高沸点的酸%浓硫酸的沸点为338℃,在试管中稍加热为宜,先沸腾,大量蒸汽生成稀硫酸注意不要吸入蒸汽,因为少量的酸会随水蒸发。难煮的是浓硫酸。
4.稀释法
沿着容器壁将浓硫酸慢慢注入水中,并保持搅拌。切勿将水注入浓硫酸中,因为它会溅出液滴。解释:水的密度低时会浮在浓硫酸上,溶解时释放的热量会使水沸腾,造成硫酸液滴飞溅,非常危险)浓硫酸稀释时会放出大量的热量
5.铁铝法
分别在试管中取少许,加入铁丝或铝片没有现象是浓硫酸,稀硫酸有气泡。因为浓硫酸可以在室温下炼铁、铝和其他金属的表面被迅速氧化,形成一层致密的氧化膜“钝化”但如果在硫酸溶液中加入少量氯离子,会催化氧化膜的分解一种观点认为氯离子与氧化膜形成络合物,另一种观点认为氯离子的半径小于氧化物的分子间间距,所以氯离子可以进入氧化膜内部,继续参与反应。
6.铜碳法
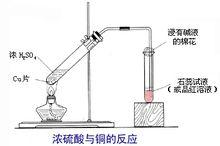
分别取两支试管,加入铜或木炭,再分别加入酸,然后加热浓硫酸会产生刺激性气体。刺激性气体是二氧化硫。
7.胆矾法
分别取两个试管,加入少许胆矾,然后分别加酸晶体溶液用稀硫酸变成蓝色,晶体表面用浓硫酸变成白色。这种变化既是物理的,也是化学的。
8.纤维素法
用玻璃棒蘸两种酸,在纸木头或棉布上画记号一段时间后,表面脱水碳化,用浓硫酸变黑。
9.蔗糖法
在小烧杯中加入约10g蔗糖,滴加1mL水,再加酸可使蔗糖脱水碳化“黑面包”的是浓硫酸。在这个反应中,浓硫酸和水放出热量促进反应,水作为催化剂。
10.露置法
浓硫酸有吸水性暴露一段时间后,浓硫酸质量增加,稀硫酸质量可能因水分挥发而下降
11.亚硝酸钠法
在试管中加入少许工业盐,然后分别加酸,浓硫酸产生刺激性气体和红色气体,工业盐溶解非刺激性气体产生稀硫酸。刺激性气体主要是二氧化氮和二氧化硫。
12.电导法
以两根碳棒为电极,插入酸中,在电路中串联一个小灯泡,与两节干电池形成闭合回路灯泡发光,比较亮的是稀硫酸由于浓硫酸中的水分较少,大部分硫酸分子没有电离,所以自由移动的离子很少,导电性差。但浓硫酸能与碳发生反应,所以要用钽等惰性金属丝做电极。注:浓硫酸由于2H2SO4=可逆=H3SO4 HSO4的自耦合电离产生自由移动的离子,所以导电性较弱)
13.氯化钠法
在两个试管中加入少量氯化钠,然后分别加入酸浓硫酸产生刺激性气味气体,氯化钠溶解无刺激性气味气体产生稀硫酸。氯化钠与浓硫酸反应生成硫酸钠和有刺激性气味的气体氯化氢。
稀释方法 编辑本段
浓硫酸的密度比水的密度大得多在浓硫酸中直接加水,会使水浮在浓硫酸表面,放出大量热量,使酸液沸腾喷溅出来,造成事故。
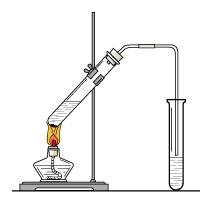
所以浓硫酸稀释时,往往是沿着装置壁慢慢注入水中(用玻璃棒抽干烧瓶中的水)并不断搅拌,使稀释产生的热量能及时散发。由图为操作方式)
千万不要颠倒顺序,会造成事故。切记“酸变成了水,沿着墙,慢慢地倒,不停地搅拌”,“将浓硫酸稀释,将浓酸加入水滴中,沿容器壁慢慢倒入,双手搅拌(化学版《青花瓷》)将酸注入水中,不断搅拌
稀释的硫酸应冷却至室温并储存在试剂瓶中。
浓硫酸和浓硝酸的混合
类似于浓硫酸用水稀释,硫酸注入硝酸,混酸氧化性很强,也常用于将醇类的羟基转化为硝酰基(硝酸酯)
物理性质 编辑本段
除了酸固有的化学性质外,浓硫酸还有自己的特殊性质,与稀硫酸有很大的不同主要原因是浓硫酸溶液中存在大量的非离子化硫酸分子(硫酸分子也可以发生自耦合电离)这些硫酸分子使浓硫酸具有很强的性质。
浓盐酸浓硝酸和浓硫酸的比较
浓盐酸 | 浓硫酸 | 浓硝酸 | |
颜色状态等 | 无色有刺激性气味的液体 | 无色黏稠,油状液体 | 无色有刺激性气味液体,如长时间放置或光照会变黄 |
个性对比 | 有挥发性,在空气里会生成白雾,有刺激性气味 | 不挥发,有吸水性(可做干燥剂),有脱水性(化学性质,使有机物炭化) | 有挥发性,在空气里会生成白雾,有刺激性气味 |
腐蚀性 | 有腐蚀性,对活泼金属腐蚀性强 | 强腐蚀性 | 强腐蚀性 |
纯硫酸是无色无味的油状液体。常用的浓硫酸中H2SO4的质量分数为98.3%,其密度为1.84g·厘米,其物质浓度为18.4mol·L。98.3%时,熔点:10℃;沸点:338℃。硫酸是一种高沸点的强酸,很难挥发它溶于水,可以与水以任何比例混合。浓硫酸溶解时放出大量的热量,所以要稀释“酸变成了水,沿着墙,慢慢地倒,不停地搅拌”
强腐蚀性
浓硫酸腐蚀性很强如果在实验过程中不小心溅到皮肤或衣服上,应立即用大量的水冲洗,这样不仅可以减少浓硫酸在皮肤上的停留时间,还可以在第一时间稀释浓硫酸,减少其对人体的危害即使溶于水也会释放热量,但大量事实证明,流水在洗涤时会带走热量,产生的热量对人体影响不大(切记不要用布擦,因为浓硫酸脱水性强,接触皮肤后会碳化如果用布擦,会擦掉皮肤组织。但如果需要在试卷上回答,则以教材内容为准),然后涂上3%~5%的碳酸氢钠溶液(切勿使用氢氧化钠等强碱)严重的病例应立即送往医院。如果在实验过程中滴在桌子上,用布擦干。
吸水性
一瓶浓硫酸放在空气中,质量会增大,密度会减小,浓度会减小,体积会增大这是因为浓硫酸有吸水性,可以吸收空气中的水分。
常做干燥剂。
浓硫酸经常被用作气体洗涤装置众所周知,浓硫酸不仅能吸收空气中的水分,还能干燥中性和酸性气体
例如中性气体:CO、氧气、氮气和所有稀有气体
酸性气体:HCI气体、二氧化碳、二氧化硫
浓硫酸不能用作碱性气体(例如氨气)因为浓硫酸和氨气反应。浓硫酸还不能干燥溴化氢、还原性气体,如碘化氢和硫化氢。
需要注意的是,硫酸不能干燥二氧化氮,因为二氧化氮溶解在浓硫酸中会产生亚硝基硫酸等物质
注:浓硫酸只有在吸收自由水分子时才具有吸水性比如它吸收五水硫酸铜中的结晶水时,是结晶水被除去,而不是吸水。要特别注意这一项,CuSO4·5H2O=CuSO4 5H2O是化学变化,表现为脱水而非吸水。
脱水性
脱水是浓硫酸的性质,不是稀硫酸,也就是浓硫酸有脱水和强脱水。
脱水是浓硫酸的化学特性,浓硫酸脱水物料的过程是一个化学变化的过程反应时,浓硫酸是基于水分子中氢原子和氧原子的比例(2∶1)捕获脱水材料中的氢原子和氧原子。
蔗糖、木屑、纸片棉花等中的有机物脱水后变成黑炭(炭化),并且会产生二氧化硫,所以实验必须在通风良好的条件下进行,否则会有危险。
反应过程分为两步首先,蔗糖C12H22O11以浓硫酸为催化剂脱水生成碳和水(试验结束后,蔗糖会变黑,而变黑的是碳粒)
C12H22O11==浓硫酸==12C 11H2O;
第二步,脱水反应产生的大量热量使浓硫酸与c反应:
C 2H2SO4=加热=CO2↑ 2SO2↑ 2H2O。
一些有机反应可以通过脱水来催化。
乙烯实验室制法(浓硫酸作为催化剂和脱水剂)CH3CH2OH=浓硫酸170℃=H2O CH2=CH2↑
强氧化性 编辑本段
金属反应
1在室温下,浓硫酸能制铁、铝等金属钝化。主要原因是硫酸分子与这些金属原子结合形成致密的氧化膜,阻止氢离子或硫酸分子继续与金属反应,如铁,一般认为生成Fe3O4。
②浓硫酸加热时可与铱钌金铂混合
除之外的所有金属都反应生成高价金属硫酸盐,通常被还原成SO2。
硫酸铜(浓)加热)====CuSO4 SO2↑ 2H2O
2Fe6h2so 4(浓)加热)====
Fe2(SO4)3 3SO2↑ 6H2O
锌2H2SO4(浓)加热)====ZnSO4 SO2↑ 2H2O
在上述反应中,硫酸表现出强氧化性和酸性。
热浓硫酸可以转化碳、硫、磷和其他非金属单质被氧化成高价氧化物或含氧酸,它们本身被还原成SO2。在这种反应中,浓硫酸只表现出氧化作用。
C 2H2SO4(浓)=加热=CO2↑ 2SO2↑ 2H2O
硫酸二硫(浓)=加热=3SO2↑ 2H2O
2P硫酸氢盐(浓)=加热=h3po 45so 2↑2H2O
3与其他还原性物质反应
浓硫酸具有强氧化性,H2S是实验室生产的、HI和其他还原性气体可以 不要选择浓硫酸作为干燥剂。
H2S硫酸(浓)=S↓ SO2↑ 2H2O
2HI H2SO4(浓)=I2ⅱso 2 H2O
难挥发性
高沸点)制氯化氢、硝酸等(原理:由难挥发酸制备挥发酸)例如,固体氯化钠与浓硫酸反应产生氯化氢气体。
2NaCl(固)+H2SO4(浓)==na2so 42HCl↑
Na2SO3 H2SO4==Na2SO4 H2O SO2↑
再例如,氯化氢气体可以通过使用浓盐酸和浓硫酸来生产。利用浓硫酸脱水,除去浓盐酸中的水分。
酸性
制化肥,如氮肥、磷肥等。
2NH3 H2SO4==(NH4)2SO4
NH3 H2SO4==NH4HSO4
Ca3(PO4)2 2H2SO4==2CaSO4 Ca(H2PO4)2
金属置换
对于金属替代,氢后的金属可以 不与酸发生反应,但浓硫酸能使某些金属发生反应,例如:
硫酸铜(浓)=加热=CuSO4 SO2↑ 2H2O
硫酸危害 编辑本段
硫酸腐蚀性极强,尤其是高浓度硫酸。高浓度硫酸不仅呈强酸性,而且具有很强的脱水和氧化性能:除了与体内的蛋白质和脂肪发生水解反应并造成严重的化学灼伤外,还会与高放热脱水的碳水化合物发生反应并使其碳化,造成二次火焰灼伤,对眼睛和皮肤造成极大的伤害。
健康危害:对皮肤、粘膜等组织有强烈的刺激和腐蚀作用。蒸汽或雾气会导致结膜炎、结膜水肿、角膜混浊,导致失明;引起呼吸道刺激,严重者出现呼吸困难和肺水肿;高浓度引起喉痉挛或声门水肿,窒息而死。口服后会引起消化道灼伤,形成溃疡;严重者可有胃穿孔、腹膜炎、肾损害、休克等。轻度皮肤烧伤的人会出现红斑、严重时会形成溃疡,愈合后疤痕收缩影响功能。溅到眼睛里会导致烧伤,甚至角膜穿孔、全眼炎以至失明。慢性影响:牙齿酸蚀症、慢性支气管炎、肺气肿和肺硬化。
环境危害:它对环境有害,会污染水和土壤。
燃爆危险:本品助燃,强腐蚀性、强烈刺激性,可引起人体灼伤和皮肉碳化。
工业制法:硫酸的原料是硫磺、硫铁矿、有色金属冶炼烟气、石膏、硫化氢、二氧化硫和废硫酸等。硫黄、硫铁矿和冶炼烟气是三种主要原料。
制取提纯 编辑本段
制取二氧化硫
燃烧硫磺或高温处理硫铁矿制取二氧化硫(我国硫铁矿多,所以常用硫铁矿)
O2═南部点燃═SO2
4FeS2 11O2═高温═8SO2 2Fe2O3
接触氧化成三氧化硫
2 O2═2SO3(五氧化二钒作为催化剂,反应是可逆的)
用98.3%硫酸吸收
xSO3 H2SO4═H2SO4·xSO3(硫酸分子与几个三氧化硫分子结合形成发烟硫酸)
SO3 H2SO4═H2S2O7(焦硫酸)
加水
H2SO4·xSO3 xH2O═(x+1)H2SO4
H2S2O7 H2O═2H2SO4
提纯工艺
工业浓硫酸可以蒸馏得到浓度为95%98%的商品浓硫酸.
其他方法
磷酸反应后,磷石膏用于工业回收,二水法生产硫酸。
经典的制备方法也是利用草酸和硫酸亚铁的反应
FeO 4H2O 4=h2so 4FEC 2 o 4ⅲ
但是草酸铁很细,很难过滤)
安全使用 编辑本段
特性
一)理化性状和用途
无色油状腐蚀性液体,有强吸湿性。密度:1.8g/厘米,熔点10.4℃,沸点:338℃。用于制造硫酸铵、磷酸、硫酸铝合成药物、合成染料、合成洗涤剂和金属酸洗剂。
二)毒性
属中等毒类。对皮肤和粘膜有很强的腐蚀性。
最高容许浓度:2mg/m³
三)短期过度暴露的影响
吸入:吸入高浓度硫酸雾可刺激上呼吸道症状,严重者出现喉头水肿、支气管炎甚至肺水肿。
眼睛接触:泼硫酸可引起结膜炎和水肿,角膜混浊和穿孔。
皮肤接触:局部刺痛,皮肤从潮红变成深褐色。
口服:误服硫酸后,口腔、咽部、胸部和腹部立即剧烈灼痛,嘴唇、口腔、咽部发现烧伤,导致溃疡黑色血性呕吐物和腹泻胃肠道穿孔。口服浓硫酸的致死剂量约为5 ml。
四)长期暴露的影响
长期接触硫酸雾可引起鼻粘膜萎缩,嗅觉丧失或消失、慢性支气管炎牙齿糜烂等症状。
五)火灾和爆炸
虽然本产品不可燃,但许多反应会引起火灾或爆炸比如和金属混合会产生可燃气体,和水混合会放出大量热量。干粉罐不要在发生火灾时使用、泡沫灭火等方法,由于干粉和泡沫的某些成分能与硫酸反应,用二氧化碳灭火器灭火,再用石灰和石灰石中和废酸。
六)化学反应性
本品为强氧化剂,易燃、还原性物质反应剧烈,还能与高锰酸钾反应生成极其危险的高锰酸酐。
七)人身防护
吸入:如果硫酸雾浓度超过接触限值,请佩戴防酸防毒面具。
眼睛:带化学防溅眼镜。
皮肤:戴橡胶手套,穿防酸工作服和胶鞋。工作场所应配备安全淋浴和洗眼设备。
八)急救
吸入:将患者移离现场至空气新鲜处,有呼吸道刺激者应吸氧。
眼睛:用大量的水或2打开你的眼睑%用碳酸氢钠溶液彻底冲洗。
皮肤:立即用大量冷水冲洗(浓硫酸对皮肤的腐蚀性很强,实际操作要用大量冷水直接冲洗),然后涂上3%~5%碳酸氢钠溶液,以防止皮肤烧伤。
口服:立即使用氧化镁悬浮液、牛奶、豆浆等内服。
注:所有患者都应及时询问医生或送往医疗机构进行治疗。
九)储藏和运输
与易燃还原性和强碱性物质分开。
包装号为5(甲)8(甲)十)
十)安全和处理
注意硫酸雾的控制,加强通风排气。车间里应该有方便的洗涤设备。
注:稀释酸时千万不要往酸里注水,只把酸注入水中,一边不断搅拌一边慢慢注入。
环境影响 编辑本段
健康危害
侵入途径:吸入、食入。
健康危害:对皮肤、粘膜等组织有强烈的刺激和腐蚀作用。会导致眼睛结膜炎、水肿、角膜混浊,导致失明;引起呼吸道刺激症状,严重者出现呼吸困难和肺水肿;高浓度引起喉痉挛或声门水肿而死亡。口服后会引起消化道灼伤,甚至溃疡形成。严重者可有胃穿孔、腹膜炎、喉痉挛和声门水肿、肾损害、休克等。慢性影响包括牙齿腐蚀、慢性支气管炎、肺气肿和肺硬化。
环境危害:它对环境有害,会污染水和土壤。
本品助燃,强腐蚀性、强烈刺激,可引起人体灼伤。
毒理资料
毒理学数据和环境行为
毒性:属中等毒性。
急性毒性:LD5080mg毫克毫克/kg(大鼠经口)LC50510mg/m³,2小时(大鼠吸入)320mg/m³,2小时(小鼠吸入)
危险特性:与易燃物(如苯)和有机物(如糖、纤维素等)接触会产生剧烈反应,甚至引起燃烧。它能与一些活性金属粉末反应并释放出氢气。遇水放出大量热量,可能发生沸腾飞溅。具有强腐蚀性。
燃烧(分解)产物:氧化硫。
管制信息
本品受管制。法规信息:危险化学品安全管理条例(一九八七年二月十七日国务院发布)化学危险物品安全管理条例实施细则(化劳发[1992]677号)工作场所安全使用化学品的规定(1996]劳部发423号)危险化学品安全使用等法律法规、生产、储存、运输、处理等方面都做了相应的规定;常用危险化学品的分类和标志(GB13690-92)将该物质归类为8类.1类酸性腐蚀品。
发源历史 编辑本段
西方早期
硫酸是在8世纪发现的。阿拉伯炼金术士贾比尔通过干馏硫酸亚铁晶体获得硫酸。
由约翰·道尔顿在1808年绘制的早期硫酸的分子图显示,硫酸的中心有一个硫原子,与三个氧原子建立共价键。
一些早期研究化学的人,如拉齐和贾比尔,也写了一份硫酸及其相关矿物的分类清单;其他的,比如Ibn·而西纳博士则更关注硫酸的种类及其医疗价值。
17世纪,德国化学家JohannRudolfGlauber将硫磺和硝酸钾的混合蒸汽加热产生硫酸在这个过程中,硝酸钾分解并氧化硫,使之成为三氧化硫,三氧化硫可与水混合,变成硫酸(SO3)
于是,在1736年,伦敦药剂师JoshuaWard用这种方法发展了大规模的硫酸生产。
1746年,约翰罗巴克应用这一原理,首创了铅室法,以较低的成本大量生产硫酸。
经过多次改进,这种方法已在工业上使用了近两个世纪。约翰罗巴克发明的生产硫酸的方法,可以生产出浓度为65%硫酸,以及后来的法国化学家约瑟夫·路易·盖-吕萨克和英国化学家约翰格洛弗对其进行了改进,使其浓度高达78%硫酸,但这个浓度仍然可以 不能满足某些工业用途。
中国早期
在中国古代,稀硫酸被称为“绿矾油”公元650 ~ 683年(唐高宗时)炼丹孤儿刚子在他的书《黄帝九鼎神丹经诀》卷九中有记载“炼石胆取精华法”,即干馏石胆(胆矾)而获得硫酸。
西方中期
在18世纪早期,硫酸的生产依赖于以下方法:黄铁矿(FeS2)被烧成硫酸亚铁(FeSO4)然后燃烧成硫酸铁,硫酸铁在480℃分解成氧化铁,可用于生产任何硫酸浓度的三氧化硫(Fe2(SO4)3)遗憾的是,这种工艺的巨大成本阻碍了浓硫酸的广泛应用。
现代
后来在1831年,英国制醋商PeregrinePhillips想到了接触法,可以较低的成本生产三氧化硫和硫酸这种方法今天已被广泛使用。
注意事项 编辑本段
泄露处理
迅速将泄漏污染区的人员撤离到安全区域,并进行隔离,严格限制出入。建议急救人员穿戴自给式正压呼吸器和防酸工作服。唐 不要直接触摸泄漏处。尽可能切断泄漏源。防止流入下水道、排洪沟等受限空间。
小量泄漏:用砂土、干石灰或苏打灰混合。也可以用大量水冲洗,稀释后放入废水系统。
大量泄漏:筑堤或挖坑住宿。用泵将其泵入槽车或专用收集器,并回收或运送至废物处理场进行处理。
操作
封闭运行,注意通风。尽可能使操作机械化、自动化。操作人员必须经过专门培训,并严格遵守操作规程。建议操作人员佩戴自吸过滤式防毒面具(全面罩)穿橡胶耐酸碱服,戴橡胶耐酸碱手套。远离火种、热源,工作场所禁止吸烟。远离易燃、可燃物。防止工作场所的蒸汽泄漏到空气中。避免与还原剂、碱类、碱金属接触。搬运时,轻拿轻放,以防损坏包装和容器。配备相应品种和数量的消防器材和泄漏应急处理设备。空容器可能会留下有害物质。稀释或配制溶液时,应在水中加入酸,以避免沸腾和飞溅。
储存
储存于阴凉、通风的库房。储槽温度不得超过35℃,相对湿度不得超过85℃%保持容器密封。应与易(可)燃物、还原剂、碱类、碱金属、食用化学品应当分开存放,不得混合存放。储存区应配备泄漏应急处理设备和合适的储存材料。
运输
该产品铁路运输时限为使用钢铁企业自备罐车装运,装运前必须报有关部门批准。非罐装铁路运输应严格按照铁道部《危险货物运输规则》中的危险品装载表进行。装运时包装应完整,装载应安全。确保容器在运输过程中不会泄漏、不倒塌、不坠落、不损坏。禁止使用易燃或可燃材料、还原剂、碱类、碱金属、食用化学品的混合运输等。
附件列表
词条内容仅供参考,如果您需要解决具体问题
(尤其在法律、医学等领域),建议您咨询相关领域专业人士。