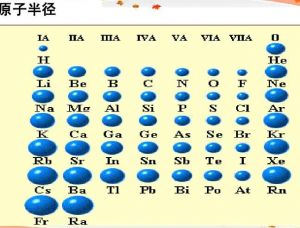
原子半径
原子半径(原子 半径)是描述原子大小的参数之一。根据不同的尺度和测量方法,原子半径的定义是不同的,常见的有轨道半径和范德华半径(也称范式半径)共价半径金属半径等。同一个原子根据不同的定义得到的原子半径可能会有很大的不同,所以在比较不同原子的相对大小时,使用的数据来源必须一致。
原子半径主要受三个因素影响电子层数核电荷数和最外层电子数。一般来说,电子层数越多,核电荷越小,最外层电子越多,原子半径越大。这也使得元素周期表中的原子半径具有明显的周期演化规律。
原子半径对元素的化学性质有很大的影响,因此原子半径的研究在化学的发展中具有重要的意义和价值。
基本介绍
影响原子半径的因素有三个:一核电荷数,核电荷越多,原子核对核外电子的吸引力越大(电子收缩到原来的原子核),原子半径越小;当电子层数相同时,其原子半径随着核电荷的增加而减小;第二个是最外层的电子数最外层电子越多,半径越大;三是电子层数(电子的层状排列与离原子核的距离和电子云之间的相互排斥有关)电子层越多,原子半径越大。当电子层结构相同时,质子数越大,半径越小。
原子半径是由上述一对矛盾因素决定的。原子半径随着核电荷的增加而减小,随着电子数和电子层数的增加而增加。当这些矛盾因素的相互作用达到平衡时,原子就有了一定的半径。
只要比较一下上述两种矛盾因素的相互作用,就不难理解了
不同原子半径的变化规律。
一.同期原子半径定律。

例如,比较钠和镁的半径。
当钠到镁的核电荷增加一个时,原子核外的每个电子增加一定的力,原子就有收缩的趋势,而原子核外的电子也增加一个电子,由于电子运动占据了一定的空间,就有增大原子半径的趋势。实验表明,钠的原子半径大于镁,说明原子半径因核电荷增加而减小,因电子增加而增大。所以相同周期元素的原子从左到右逐渐减少(稀有气体除外)
二.相邻周期元素原子半径的比较。
实验结果表明,钾原子的半径就是钠原子的半径,说明从钠到钾,原子半径增加八个电子一个电子层,原子半径减少八个核电荷。因此,同一主族元素的原子半径从上到下逐渐增大。从氖到钠,核电荷增加一个,核外电子和电子层都增加一个由此推断,钠的半径就是氖的半径,即:原子半径上的一个电子和一个电子层的增加,以及由于增加的核电荷而导致的原子半径的减少。值得注意的是,电子层数多的原子半径不一定大,比如:锂原子半径和铝原子半径。这是因为当核电荷增加到八以上时,原子核半径的减小越来越强,已经超过了增加一个电子层对半径的增加。
三.原子及其阴离子或阳离子半径的比较。
比如氯原子和氯离子半径的比较。
它们的核电荷相同,只是氯离子多了一个电子,占据了一定的空间,所以氯离子的半径就是氯原子的半径。
原子及其阳离子的半径正好与上述相反。例如:钠离子半径和钠原子半径。
四.相同电子层结构但不同核电荷的粒子半径比较。
例如钠离子镁离子氧离子和氟离子半径的比较。
由于核外电子层结构相同,显而易见,核电荷越多,核外电子的引力越大,粒子半径越小。所以它的粒子半径是:镁离子钠离子氟离子和氧离子。
化学术语

通常指用实验方法测得的两个相邻原子核间距离的一半。理论上,原子核外的电子没有严格固定的轨道,所以原子的大小没有严格的边界,无法精确测量单个原子的半径,所以常用的原子半径数据只是相对的、近似的意义。根据测定方法的不同,原子半径有三种
1)共价半径:两原子之间(原子可以相同,也可以不同)当通过共价键结合时,两个原子核之间距离的一半。其实原子核之间的距离就是共价键的键长。
2)金属半径:金属晶体中两个相邻金属原子间距离的一半。
3)范式半径:范德华力吸引的相邻不同分子中两个相同原子核间距离的一半。
原子半径与以下三个方面有关
电子层数为 ,原子核内质子数为
原子核中的质子数=核电荷数)
1.电子层越多, 的原子半径越大(适用于同主族)
2.原子核内有 个质子,所以原子核的质量更大, 对电子的束缚能力更强,但是 的原子半径更小
3.电子越多, 原子的半径就越大
对比同期 的原子半径,可以看到核内质

子数
比较同一组元素取决于电子层数
如果两种元素的周期和族不同,那么主要认为电子层 的数目与最外层电子数无关
如果假定原子是一个球体,标准原子的直径约为10-10米。
2补充特别说明:指原子相互作用有效范围的一半,即相邻原子核间距离的一半。原子半径约为10(10)m。
分类
原子没有确切的大小所谓有效尺寸,是指原子在化学运动中表现出来的原子间距,即引力和斥力的平衡距离。
根据相互作用力的不同,有以下几种有效半径:
范德华半径、金属半径、离子半径和共价半径。
范德华
相互作用力
分子间相互作用力(3356部队)
主要有:荷电基团、偶极子、诱导偶极子之间的相互作用,氢键、疏水基团的相互作用堆积和非键电子排斥等。
取向力(方向 力)
固有偶极子之间的电吸引
当极性分子相互靠近时,同极相斥,异极相吸,使分子在空间按一定的取向排列,系统处于更稳定的状态。偶极子之间的这种固有力称为取向力。其实质是静电力。
诱导力(感应 力)
感应偶极子和固有偶极子之间的电吸引

瞬时偶极子的产生引起的分子间的相互作用称为分散力
总结:定向力诱导力和分散力合称为van der Waals力。极性分子之间存在取向力、诱导力和分散力,极性分子和非极性分子之间有诱导力和分散力,非极性分子和非极性分子之间有分散力。
氢键(氢 债券)
X—H…y用于表示氢键,其中x—Hσ键的电子云偏向高电负性的X原子,导致一个被屏蔽的带正电的小氢核的出现,它被另一个高电负性的Y原子强烈吸引。
氢键的一些特点:
1)方向性:由于H原子的尺寸很小,为了减少X和Y之间的斥力,它们应该尽量远离,键角接近180°,这就是氢键的方向性
2)饱和性:由于氢原子的尺寸很小,与较大的x不同、Y接触后,另一个更大的原子很难再接近它,所以氢键中氢的配位数一般是2,这就是氢键的饱和。
范德华半径
分子间作用能E-r曲线会有最低点。这个最低点对应的距离就是平衡距离。也就是说,当分子相互靠近,引力和斥力达到平衡时,系统的能量最低。此时,分子之间保持一定的接触距离。与相邻分子接触的原子之间的距离是两个原子的范德华半径之和。范德华半径大于共价半径,变化范围也大,即守恒性差。
金属原子半径
将原子间最近的接触距离除以2,得到金属原子半径。
元素周期表中金属原子半径的变化有一定的规律性
1.同一组元素的原子半径随着原子序数的增加而增加
2.除少数例外,同一周期内金属元素的原子半径从左到右逐渐减小,然后缓慢增大。
3.镧系收缩效应
受镧的收缩效应影响,第二长周期的同源元素半径大于第一长周期,但第三长周期和第二长周期的同源元素半径很接近,Zr和Hf、Nb和Ta、Mo和W的半径非常相似,使得它们极难分离,而Ru、Rh、Pd、Os、Ir、Pt 6元素的原子半径和化学性质相似,一般称为铂族元素。
金属原子的半径与配位数有关,配位数高,半径大
共价半径
当同一元素的两个电子通过共价键 连接时,它们的原子核之间的距离是1/2称为原子的共价半径(如H2、O2 )

用原子共价半径计算键长时,要考虑以下两种情况
1)异核原子间键长的计算值往往略大于实验值。
共价键长度的极性校正:Shomaker-斯蒂文森公式。
2)同一化学键对于不同的分子有其特殊性,键长也不同。例如同是C-C键,由于杂化形式的变化,当键中S轨道的组成发生变化时,C—c键长也会改变,
当存在离域∏键或其他复杂键时,键长就不能再用共价单键半径来计算了。相反,根据键长,我们可以知道键的性质。
离子半径
在离子晶体中,相邻离子之间的距离等于两个离子半径之和。
离子半径的测定
Lande离子
Lande(朗德)在1920年,通过对比下表(表中括号内的数字是以后更精确的测量值)在具有NaCl型结构的化合物的晶胞参数之后,认为MgS和MgS、MgSe和MnSe的晶胞参数几乎相等,说明负离子和负离子在晶体中已经接触。他用简单的几何关系推导出S2-和Se2-的离子半径。
瓦萨斯雅那
瓦萨斯特杰纳(瓦萨斯雅那)1925年,根据离子的摩尔折射与其体积成正比的方法.划分离子的大小。获得了8个正离子和8个负离子半径.括F-133pm)和O2-下午132 )
哥希密特
戈德施密特(哥希密持)1927年,瓦萨斯特杰纳的F-和O2-根据离子晶体中离子间接触距离的数据,导出了80多种离子的半径(戈德施密特离子半径),至今仍在通用。
Pauling
1927年,鲍林基于五块水晶(NaF、KCl、RbBr、犯罪现场调查和Li2O)根据核间距数据,用半经验方法推导出大量离子半径。因为一个离子的大小是由其最外层电子的分布决定的,而最外层电子的分布与有效核电荷成反比。
Shannon
Shanon等人根据离子的配位数、配位多面体的几何构型、根据不同条件下的接触距离,推导出离子半径。一套以O2-半径140pm,另一套是O2-从132pm的半径开始,得到了两组有效离子半径。
大小变化趋势
1) 同一个主基团,同一个电荷离子,半径从上到下递增。
李娜K Rb Cs;F-Cl-Br-I-。
2) 同一周期元素核外电子数相同的正离子,随着正电荷的增加而显著减少。
3) 对于同一元素核外各种价态的离子,电子越多,离子半径越大。
4)随着负电价的增加,核外电子数相同的 负离子对半径略有增加,但附加值不大。
5) 中镧系元素的三价正离子半径从La3减小到Lu3,这是由镧系收缩效应引起的。